BOUTIQUE精品展示
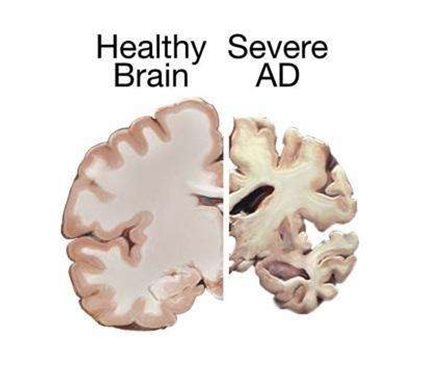
阿爾茲海默病的發(fā)生,與家族遺傳、疾病史和生活方式等因素有關(guān),大約25%的阿爾茲海默病病例是由于家族遺傳原因導致的。目前也發(fā)現多種易感基因增加了疾病發(fā)展的風(fēng)險,例如APOE基因具有三種等位變異,即e2,e3和e4,它們編碼不同的蛋白質(zhì)異構體,APOE e4等位基因的雜合子或純合子的存在增加了發(fā)病的風(fēng)險。其它與早發(fā)性阿爾茲海默病相關(guān)的基因包括APP,PSEN1和PSEN2。其它增加遲發(fā)性阿爾茲海默病發(fā)病風(fēng)險的基因有ABCA7,AKAP9, BIN1, CASS4, CD2AP, CD33, CLU, EPHA1, FERMT2, HLA-DRB5/DRB1, INPP5D, MEF2C, MS4A6A/MS4A4E, PICALM, PLD3, PTK2B, SORL1, TREM2和UNC5C。
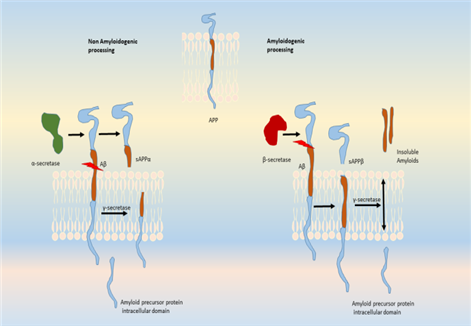
阿爾茲海默病的發(fā)病機制被歸因于大腦皮層和邊緣神經(jīng)元中β淀粉樣蛋白和細胞內高磷酸化微管相關(guān)蛋白聚集物(Tau聚集物)在細胞外的積累[1]。淀粉樣蛋白積累發(fā)生于γ分泌酶和BACE1對淀粉樣蛋白前體蛋白(APP)的改變切割,以產(chǎn)生不溶性Aβ纖維。這些原纖維聚集,進(jìn)入突觸間隙,干擾突觸信號,并聚合成斑塊。聚合激活激酶,導致Tau蛋白的過(guò)度磷酸化和聚合成神經(jīng)纖維纏結。斑塊和纏結的積累觸發(fā)了小膠質(zhì)細胞的激活和局部炎癥反應[2]。神經(jīng)纖維纏結(NFTs)是微管相關(guān)-protein (Tau)過(guò)度磷酸化的結果。蛋白與微管蛋白共同組裝形成成熟的微管。當Aβ纖維在細胞微環(huán)境中積累時(shí),釋放的激酶會(huì )使-protein過(guò)度磷酸化,導致其寡聚并聚集成NFTs。這些神經(jīng)元胞質(zhì)內高度不溶性的NFTs積累導致神經(jīng)元之間通訊的丟失,最終導致細胞凋亡。其他激酶也參與蛋白的磷酸化或APP的加工,包括GSK3β,CDK5,蛋白激酶C,蛋白激酶A,ERK2,caspase 3和caspase 9。此外,參與蛋白過(guò)磷酸化的其他激酶包括MAPK,ERK1,MEK,MARK,JNKs,p38和PKA。斑塊形成過(guò)程中的小膠質(zhì)細胞浸潤也被證明會(huì )加劇阿爾茲海默病的發(fā)病。細胞外和細胞內的斑塊和NFTs引起毒性和小膠質(zhì)細胞浸潤以及促炎細胞因子和趨化因子的釋放,觸發(fā)斑塊區域的免疫反應。其他與阿爾茲海默病相關(guān)的基因包括早老素(PSEN1和PSEN2),它們屬于γ-分泌酶家族,其突變與早發(fā)性阿爾茲海默病相關(guān)。除此之外,G蛋白偶聯(lián)受體(GPCRs)家族已被確定參與中樞神經(jīng)系統疾病和阿爾茲海默病[3]。GPCRs是一個(gè)膜蛋白超家族,包括5個(gè)不同的家族成員,即rhodopsin (a家族)、secretin (B家族)、glutamate (C家族)、adhesion(粘連)和Frizzled/Taste2。GPCRs參與了阿爾茲海默病的發(fā)病機制,并被證明與BACE1和γ分泌酶結合,這兩種酶都參與了APP的水解處理[4]。
盡管目前還沒(méi)有藥物可以逆轉阿爾茲海默病,但許多治療藥物被用來(lái)對抗這種疾病中出現的神經(jīng)遞質(zhì)短缺和失衡。例如:乙酰膽堿酯酶抑制劑(AChEIs),如多奈哌齊、加蘭他敏和利瓦斯汀,可增加突觸上乙酰膽堿的可利用性。臨床試驗中的其他藥物如γ-分泌酶抑制劑,BACE抑制劑,α-分泌酶調節劑,淀粉樣蛋白聚集抑制劑等針對細胞外間隙和神經(jīng)元中異常蛋白(淀粉樣蛋白和tau蛋白)的積累,以防止它們的錯誤折疊。激酶抑制劑也是正在研究的治療靶點(diǎn),以防止tau蛋白的過(guò)度磷酸化或聚集。其他正在進(jìn)行臨床試驗的治療方法包括抗炎藥物和補體阻滯劑,促進(jìn)神經(jīng)再生的生長(cháng)因子,以及干細胞治療。
目前商業(yè)可用的即用型試劑可以減少阿爾茲海默病研究時(shí)間,控制成本。西美杰代理的Lifespan,Agrisera,MyBioSource是全球專(zhuān)業(yè)的抗體及ELISA試劑盒研發(fā)供應商。為廣大客戶(hù)提供高質(zhì)量產(chǎn)品及專(zhuān)業(yè)的售前售后技術(shù)服務(wù)。小編匯總了有關(guān)阿爾茲海默病研究的部分相關(guān)產(chǎn)品:
|
品牌 |
貨號 |
品名 |
|
Agrisera |
AS20 4455 |
APP | Amyloid Precursor Protein (N-term) |
|
Agrisera |
AS06 154 |
PEN2 | gamma-secretase subunit PEN-2 |
|
Agrisera |
AS10 932 |
Amyloid beta oligomer-specific monoclonal antibody (OMAB) |
|
Agrisera |
AS13 2691 |
BDNF | Brain-derived neurotrophic factor |
|
Lifespan |
LS-A1193 |
IHC?plus? Polyclonal Rabbit anti?Human GPR68 / OGR1 Antibody (Extracellular Domain, IHC) |
|
Lifespan |
LS?A443 |
PathPlusTM Polyclonal Rabbit anti?Human GPR78 Antibody (Cytoplasmic Domain, IHC) |
|
Lifespan |
LS?A7979
|
PathPlusTM Polyclonal Rabbit anti?Human CDC7 Antibody (Kinase Domain, IHC) |
|
Lifespan |
LS?A463 |
PathPlusTM Polyclonal Rabbit anti?Human NPFF2 / NPFFR2 Antibody (N?Terminus, IHC) |
|
Lifespan |
LS?A1851 |
PathPlusTM Polyclonal Rabbit anti?Human OR51E1 Antibody (Cytoplasmic Domain, IHC) |
|
Lifespan |
LS-F9437 |
Human TRPA1 (Sandwich ELISA) ELISA Kit |
|
Lifespan |
LS-F35287 |
Human CDK12 / CRKRS (Sandwich ELISA) ELISA Kit |
|
Lifespan |
LS-F22046 |
Human GPER1 / GPR30 (Sandwich ELISA) ELISA Kit |
|
Lifespan |
LS-F22050 |
Human PRKCZ / PKC-Zeta (Sandwich ELISA) ELISA Kit |
|
MyBioSource |
MBS9343770 |
Human Phosphorylated Tau (PT) ELISA Kit |
|
MyBioSource |
MBS2533168 |
Human Beta Amyloid (Abeta42) CLIA Kit |
|
MyBioSource |
MBS269761 |
Human Beta Amyloid Precursor Protein (betaAPP), ELISA Kit |
|
MyBioSource |
MBS7041908 |
Beta Amyloid Polyclonal Antibody Pair |
|
MyBioSource |
MBS960834 |
Recombinant Human Beta Amyloid protein |
|
MyBioSource |
MBS639489 |
Alzheimer's Disease, Brain Tissue Microarray |
|
MyBioSource |
MBS654365 |
Alzheimer's Disease, Brain Genomic DNA |
北京西美杰作為L(cháng)ifeSpan,Agrisera,MyBioSource品牌中國授權代理,為廣大客戶(hù)提供一站式售前售后服務(wù)。如對更多阿爾茲海默病相關(guān)產(chǎn)品感興趣歡迎撥打西美杰客服熱線(xiàn)400-050-4006或登錄官方網(wǎng)站www.nnhuixin.com了解更多信息。
[1] Tiwari S et al. Alzheimer’s disease: pathogenesis, diagnostics, and therapeutics. (2019) Int J Nanomedicine. 14:5541-5554. https://doi.org:10.2147/IJN.S200490
[2]Crews, L Masliah E. Molecular mechanisms of neurodegeneration in Alzheimer’s disease. (2010). Hum Mol Genet. 19(R1):R12-R20. https://doi:10.1093/hmg/ddq160
[3]Xu, Y et al. (2020). GPR68 deletion impairs hippocampal long-term potentiation and passive avoidance behavior. Molecular Brain. 13:132. https://doi.org/10.1186/s13041-020-00672-8
[4] Zhao, J et al. (2016). G Protein-Coupled Receptors (GPCRs) in Alzheimer’s Disease: A Focus on BACE1 Related GPCRs. Frontiers in Aging Neuroscience Vol8, Article 58:1-15. https://doi.org/10.3389/fnagi.2016.00058


 京公網(wǎng)安備 11010802028692號
京公網(wǎng)安備 11010802028692號  北京客服1
北京客服1